kategorier: Udvalgte artikler » Begynderelektrikere
Antal visninger: 52646
Kommentarer til artiklen: 4
Transistorer. Del 2. Ledere, isolatorer og halvledere
Begyndelsen af artiklen: Transistor historie, Transistorer: formål, enhed og driftsprincipper
 I elektroteknik anvendes forskellige materialer. Stoffernes elektriske egenskaber bestemmes af antallet af elektroner i den ydre valensbane. Jo færre elektroner er i denne bane, jo svagere er de forbundet med kernen, jo lettere kan de gå til at rejse.
I elektroteknik anvendes forskellige materialer. Stoffernes elektriske egenskaber bestemmes af antallet af elektroner i den ydre valensbane. Jo færre elektroner er i denne bane, jo svagere er de forbundet med kernen, jo lettere kan de gå til at rejse.
Under påvirkning af temperatursvingninger bryder elektroner væk fra atomet og bevæger sig i det interatomiske rum. Sådanne elektroner kaldes fri, og de skaber en elektrisk strøm i lederne. Er der et stort interatomisk rum, er der plads til fri elektroner til at rejse ind i stof?
Strukturen af faste stoffer og væsker virker kontinuerlig og tæt, hvilket minder om strukturen af en trådkugle. Men faktisk er selv faste stoffer mere som et fiskeri- eller volleyballnet. Dette kan naturligvis ikke skelnes på husholdningsniveau, men det er konstateret ved nøjagtige videnskabelige undersøgelser, at afstandene mellem elektronerne og atomkernen er meget større end deres egne dimensioner.
Hvis størrelsen på atomkernen præsenteres i form af en kugle på størrelse med en fodboldkugle, vil elektronerne i denne model være på størrelse med en ærter, og hver sådan ærter er placeret fra "kernen" i en afstand af flere hundrede og endda tusinder af meter. Og mellem kernen og elektronet er tomhed - der er simpelthen intet! Hvis vi forestiller os afstandene mellem materiens atomer i samme skala, vil dimensionerne overhovedet vise sig at være fantastiske - titusinder og hundreder af kilometer!
Gode ledere af elektricitet er metaller. For eksempel har atomerne i guld og sølv kun en elektron i den ydre bane, derfor er de de bedste ledere. Jern leder også elektricitet, men lidt værre.
Led elektricitet endnu værre legeringer med høj modstand. Disse er nichrome, manganin, constantan, fechral og andre. En sådan række legeringer med høj modstand er på grund af det faktum, at de er designet til at løse forskellige problemer: varmeelementer, stempelmålere, referencemodstande til måleinstrumenter og meget mere.
For at evaluere et materiales evne til at lede elektricitet er begrebet "Elektrisk ledningsevne". Returværdien er modstand. I mekanik svarer disse begreber til den specifikke tyngdekraft.
isolatoreri modsætning til ledere er de ikke tilbøjelige til at miste elektroner. I dem er elektron-kernebindingen meget stærk, og der er næsten ingen frie elektroner. Mere præcist, men meget få. Samtidig er der i nogle isolatorer flere af dem, og deres isoleringskvalitet er følgelig værre. Det er nok at sammenligne for eksempel keramik og papir. Derfor kan isolatorer betinget opdeles i godt og dårligt.
Uden af frie ladninger, selv i isolatorer, skyldes termiske vibrationer af elektroner: under påvirkning af høj temperatur forringes isoleringsegenskaberne, nogle elektroner formår stadig at bryde væk fra kernen.
Tilsvarende ville resistiviteten af en ideel leder være nul. Men heldigvis er der ingen sådan leder: forestil dig, hvordan Ohms lov ((I = U / R) ville se ud med nul i nævneren !!! Farvel til matematik og elektroteknik).
Og kun ved en absolut nul temperatur (-273,2 ° C) stopper de termiske udsving helt, og den værste isolator bliver god nok. For at bestemme numerisk "er dette" dårligt - brug godt af begrebet resistivitet. Dette er modstanden i en kubes ohm med en kantlængde på 1 cm, resistensdimensionen opnås i ohm / cm. Den specifikke resistens for nogle stoffer er vist nedenfor.Konduktivitet er den gensidige gengivelse af resistiviteten, er måleenheden for Siemens, - 1Sm = 1 / Ohm.
De har god ledningsevne eller lav modstand: sølv 1,5 * 10 ^ (- 6), læs hvordan (halvanden til ti til effekten minus seks), kobber 1,78 * 10 ^ (- 6), aluminium 2,8 * 10 ^ (- 6). Konduktiviteten hos legeringer med høj modstand er meget værre: konstant 0,5 * 10 ^ (- 4), nichrom 1,1 * 10 ^ (- 4). Disse legeringer kan kaldes dårlige ledere. Efter alle disse komplekse tal skal du erstatte Ohm / cm.
I en separat gruppe kan halvledere også skelnes: germanium 60 Ohm / cm, silicium 5000 Ohm / cm, selen 100 000 Ohm / cm. Modstandsevnen for denne gruppe er større end for dårlige ledere, men mindre end for dårlige isolatorer, for ikke at nævne gode. Med samme succes kunne halvledere sandsynligvis kaldes halvisolatorer.
Efter så kort kendskab til strukturen og egenskaberne ved et atom, bør man overveje, hvordan atomer interagerer med hinanden, hvordan atomer interagerer med hinanden, hvordan molekyler er lavet af dem, hvorfra forskellige stoffer er sammensat. For at gøre dette bliver du igen nødt til at huske elektronerne i atomens ydre bane. Det er trods alt de, der deltager i bindingen af atomer til molekyler og bestemmer de fysiske og kemiske egenskaber ved stof.
Sådan fremstilles atomer af atomer
Ethvert atom er i en stabil tilstand, hvis der er 8 elektroner i dets ydre bane. Han søger ikke at tage elektroner fra nabolandet atomer, men han opgiver ikke sine egne. For at verificere dette er det nok i den periodiske tabel at se på inerte gasser: neon, argon, krypton, xenon. Hver af dem har 8 elektroner i den ydre bane, hvilket forklarer, at disse gasser er uvillige til at indgå i nogen relation (kemiske reaktioner) med andre atomer til at opbygge molekyler med kemikalier.
Situationen er en helt anden for de atomer, der ikke har 8 dyrebare elektroner i deres ydre bane. Sådanne atomer foretrækker at forene sig med andre for at supplere deres ydre bane med op til 8 elektroner og finde en rolig stabil tilstand.
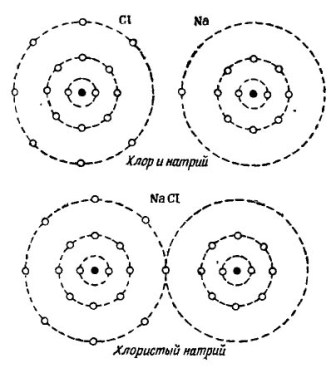
For eksempel det velkendte vandmolekyle H2O. Det består af to hydrogenatomer og et iltatom, som vist på figuren. 1.
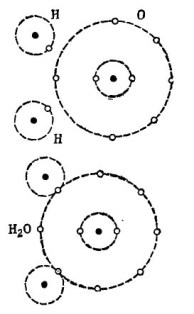
billede 1. Sådan oprettes et vandmolekyle.
I den øverste del af figuren er to hydrogenatomer og et iltatom vist separat. Der er 6 elektroner i den ydre bane af ilt, og to elektroner ved to brintatomer er i nærheden. Oxygen indtil det elskede nummer 8 mangler kun to elektroner i den ydre bane, som han vil modtage ved at tilføje to hydrogenatomer til sig selv.
Hvert brintatom til fuldstændig lykke mangler 7 elektroner i den ydre bane. Det første hydrogenatom modtager i sin ydre bane 6 elektroner fra ilt og en anden elektron fra dets tvilling - det andet hydrogenatom. Der er nu 8 elektroner i dens ydre bane sammen med dets elektron. Det andet hydrogenatom afslutter også sin ydre bane til det elskede nummer 8. Denne proces er vist i den nedre del af figuren. 1.
På billedet 2 Processen med at kombinere natrium- og kloratomer vises. Resultatet er natriumchlorid, der sælges i butikker kaldet salt.
billede 2. Processen med at kombinere natrium- og kloratomer
Også her modtager hver af deltagerne det manglende antal elektroner fra den anden: klor fastgør et enkelt natriumelektron til sine egne syv elektroner, mens det giver sine atomer til natriumatom. Begge atomer i den ydre bane har 8 elektroner, hvor der opnås fuld enighed og velstand.
Atomenes valencitet
Atomer med 6 eller 7 elektroner i deres ydre bane har en tendens til at knytte 1 eller 2 elektroner til sig selv. De siger om sådanne atomer, at de er et eller divalent. Men hvis det ligger i den ydre bane af et atom 1, 2 eller 3 elektroner, har et sådant atom en tendens til at give dem væk. I dette tilfælde betragtes atomet som et, to eller trivalent.
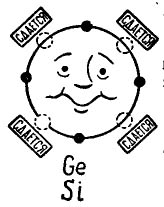
Hvis der er 4 elektroner i den ydre bane til et atom, foretrækker et sådant atom at kombinere med det samme, som også har 4 elektroner. Sådan kombineres germanium- og siliciumatomer, der bruges til produktion af transistorer. I dette tilfælde kaldes atomerne tetravalent. (Atomerne fra germanium eller silicium kan kombineres med andre elementer, for eksempel ilt eller brint, men disse forbindelser er ikke interessante i planen for vores historie.)
På billedet 3 der vises et germanium- eller siliciumatom, som ønsker at kombinere med det samme atom. De små sorte cirkler er atomets egne elektroner, og lyscirklerne angiver de steder, hvor elektronerne fra de fire atomer - naboer - falder.
billede 3. Germaniumatom (silicium).
Halvleders krystalstruktur
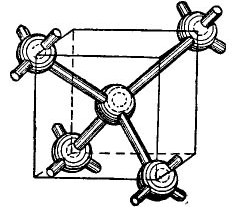
Atomerne fra germanium og silicium i den periodiske tabel er i samme gruppe med kulstof (den kemiske formel for diamant C er simpelthen store kulstofkrystaller opnået under visse betingelser), og danner derfor, når de kombineres, en diamantlignende krystallinsk struktur. Dannelsen af en sådan struktur er vist i en forenklet, selvfølgelig, form i figuren 4.
billede 4.
I midten af terningen er et germaniumatom, og 4 flere atomer er placeret i hjørnerne. Atomet afbildet i midten af terningen er bundet af dets valenselektroner til dets nærmeste naboer. Til gengæld giver de kantede atomer deres valenselektroner til det atom, der er placeret i midten af terningen og dets naboer - atomer, der ikke er vist på figuren. Således suppleres de ydre baner med op til otte elektroner. Der er selvfølgelig ingen terning i krystalgitteret, det er bare vist på figuren, så det gensidige, volumetriske arrangement af atomer er klart.
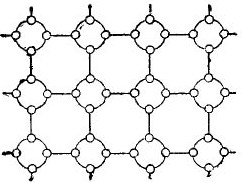
Men for at forenkle historien om halvledere så meget som muligt kan krystalgitteret afbildes som en flad skematisk tegning, på trods af at de interatomiske bindinger ikke desto mindre er placeret i rummet. Et sådant kredsløb er vist på figuren. 5.
billede 5. Germanium krystalgitteret i en flad form.
I en sådan krystal er alle elektroner tæt bundet til atomer ved deres valensbindinger, derfor er der tilsyneladende ganske enkelt ingen frie elektroner her. Det viser sig, at foran os er en isolator i figuren, da der ikke er nogen frie elektroner i den. Men det er faktisk ikke sådan.
Intrinsisk ledningsevne
Faktum er, at under indflydelse af temperatur lykkes nogle elektroner stadig med at bryde væk fra deres atomer og i nogen tid frigøre sig fra bindingen med kernen. Derfor findes der en lille mængde frie elektroner i en germaniumkrystall, som det er muligt at lede en elektrisk strøm på. Hvor mange gratis elektroner findes i en germaniumkrystall under normale forhold?
Der er ikke mere end to sådanne frie elektroner pr. 10 ^ 10 (ti milliarder) atomer, derfor er germanium en dårlig leder, eller som halvlederen er sædvanlig at sige. Det skal bemærkes, at kun et gram germanium indeholder 10 ^ 22 (ti tusind milliarder milliarder) atomer, som giver dig mulighed for at "få" omkring to tusind milliarder gratis elektroner. Det ser ud til at være nok til at passere en stor elektrisk strøm. For at tackle dette problem er det nok at huske, hvad strømmen på 1 A.
En strøm på 1 A svarer til at passere gennem en leder på et sekund en elektrisk ladning på 1 Coulomb, eller 6 * 10 ^ 18 (seks milliarder milliarder) elektroner pr. Sekund. På denne baggrund er det usandsynligt, at to tusind milliarder gratis elektroner og endda spredt over en enorm krystal vil sikre passagen af høje strømme. Selvom der på grund af termisk bevægelse findes lille ledningsevne i Tyskland. Dette er den såkaldte iboende ledningsevne.
Elektronisk og hulledningsevne
Når temperaturen stiger, overføres yderligere energi til elektronerne, deres termiske vibrationer bliver mere energiske, som et resultat af, at nogle elektroner formår at bryde væk fra deres atomer.Disse elektroner bliver frie og i mangel af et eksternt elektrisk felt foretager tilfældige bevægelser og bevæger sig i frit rum.
Atomer, der har mistet elektroner, kan ikke foretage tilfældige bevægelser, men kun svinge svagt i forhold til deres normale position i krystalgitteret. Sådanne atomer, der har mistet elektroner, kaldes positive ioner. Vi kan antage, at i stedet for elektroner, der er revet fra deres atomer, opnås frie rum, som normalt kaldes huller.
Generelt er antallet af elektroner og huller det samme, så et hul kan fange en elektron, der er i nærheden. Som et resultat bliver et atom fra en positiv ion igen neutral. Processen med at kombinere elektroner med huller kaldes rekombination.
På samme frekvens adskilles elektroner fra atomer, derfor er antallet af elektroner og huller for en bestemt halvleder i gennemsnit lig med, er konstant og afhængig af eksterne forhold, især temperatur.
Hvis der påføres en spænding til halvlederkrystallen, ordnes elektronbevægelsen, en strøm strømmer gennem krystallen på grund af dens elektron- og hulledningsevne. Denne ledningsevne kaldes iboende, den blev allerede nævnt lidt højere.
Men halvledere i deres rene form, med elektronisk ledning og hulledningsevne, er uegnede til fremstilling af dioder, transistorer og andre detaljer, da grundlaget for disse enheder er p-n (læs “pe-en”) -krydset.
For at opnå en sådan overgang er der behov for to typer halvledere, to typer konduktivitet (p - positiv - positiv, hul) og (n - negativ - negativ, elektronisk). Disse typer af halvledere opnås ved doping, tilsætning af urenheder til rene krystaller af germanium eller silicium.
Selvom mængden af urenheder er meget lille, ændrer deres tilstedeværelse i vid udstrækning egenskaberne ved halvlederen, så du kan få halvledere med forskellig konduktivitet. Dette vil blive diskuteret i næste del af artiklen.
Boris Aladyshkin, electro-da.tomathouse.com
Se også på elektrohomepro.com
: