kategorier: Begynderelektrikere, Industriel elektriker
Antal visninger: 37528
Kommentarer til artiklen: 0
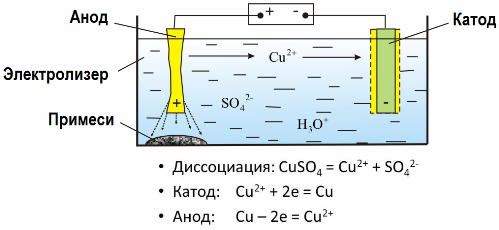
Den praktiske anvendelse af elektrolyse
Når en elektrisk strøm passerer gennem en opløsning eller en smeltning af en elektrolyt, frigives opløste elektroder eller andre stoffer, der er produkterne fra sekundære reaktioner på elektroderne, på elektroderne. Denne fysisk-kemiske proces kaldes elektrolyse.
Essensen af elektrolyse
I det elektriske felt, der er skabt af elektroderne, kommer ioner i ledende væske i en ordnet bevægelse. Den negative elektrode er katoden, den positive er anoden.
Negative ioner kaldet anioner (ioner af hydroxylgruppen og sure rester) skynder sig til anoden, og positive ioner kaldet kationer (brint, metal, ammoniumioner osv.) Skynder sig til katoden
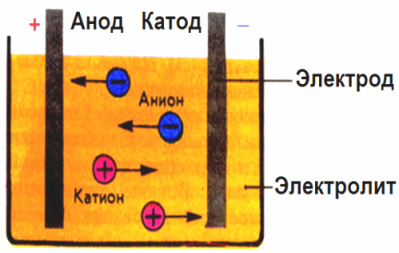
En oxidationsreduktionsproces finder sted ved elektroderne: elektrokemisk reduktion af partikler (atomer, molekyler, kationer) forekommer ved katoden, og elektrokemisk oxidation af partikler (atomer, molekyler, anioner) forekommer ved anoden. Dissocieringsreaktioner i en elektrolyt er primære reaktioner, og reaktioner, der forløber direkte ved elektroderne, kaldes sekundære.
Lovene i Faraday elektrolyse
Opdelingen af elektrolysereaktioner i primær og sekundær hjalp Michael Faraday med at etablere elektrolyselovene:
-
Den første lov om Faraday-elektrolyse: massen af det stof, der afsættes på elektroden under elektrolyse, er direkte proportionalt med mængden af elektricitet, der overføres til denne elektrode. Med mængden af elektricitet menes en elektrisk ladning målt som regel i vedhæng.
-
Faradays elektrolyses anden lov: for en given mængde elektricitet (elektrisk ladning) er massen af et kemisk element, der er afsat på elektroden, direkte proportional med den ækvivalente masse af elementet. Den ækvivalente masse af et stof er dens molære masse divideret med et heltal, afhængigt af den kemiske reaktion, hvor stoffet er involveret.
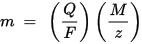
m er massen af det stof, der er afsat på elektroden, Q er den samlede elektriske ladning, der passerer gennem stoffet F = 96,485,33 (83) C mol - 1 er Faraday-konstanten, M er stoffets molære masse (F.eks. den molære masse af vand H2O = 18 g / mol), z er et valens antal ioner af et stof (antallet af elektroner pr. ion).
Bemærk, at M / z er den ækvivalente masse af det udfældede stof. I den første Faraday-lov er M, F og z konstanter, så jo større værdien af Q, desto større er værdien af m. For den anden Faraday-lov er Q, F og z konstanter, så jo større værdien af M / z (ækvivalent masse), desto større er værdien af m.
Elektrolyse anvendes i dag i industrien og inden for teknologi. For eksempel er det elektrolyse, der tjener som en af de mest effektive metoder til industriel produktion af brint, brintperoxid, mangandioxid, aluminium, natrium, magnesium, calcium og andre stoffer. Elektrolyse bruges til behandling af spildevand, elektroplettering, elektroplettering og endelig i kemiske strømkilder. Men først ting først.
Opnåelse af rene metaller fra malm ved elektrolyse
Takket være elektrolyse ekstraheres mange metaller fra malm og underkastes yderligere behandling. Så når malm eller beriget malm - koncentrat - behandles med reagenser, passerer metallet ind i opløsningen, og derefter isoleres metallet ved hjælp af elektroekstraktion fra opløsningen. Rent metal frigives på samme tid ved katoden. På denne måde modtager zink, kobber, cadmium.
Metaller underkastes elektrofinering for at eliminere urenheder og for at omdanne de indeholdte urenheder til en form, der er praktisk til yderligere behandling. Metallet, der skal renses, støbes i form af plader, og disse plader bruges som anoder i elektrolyse.
Når strømmen passerer, opløses anodens metal, passerer i form af kationer i opløsningen, derefter kationerne udledes ved katoden og danner et bundfald af rent metal. Forureninger i anoden opløses ikke - de udfældes med anodeslam eller passerer ind i elektrolytten, hvorfra de kontinuerligt eller periodisk fjernes.
Overvej som et eksempel kobberelektrefinering. Hovedkomponenten i opløsningen - kobbersulfat - det mest almindelige og billigste salt af dette metal. Opløsningen har en lav elektrisk ledningsevne. For at øge den tilsættes svovlsyre til elektrolytten.
Derudover indføres små mængder tilsætningsstoffer i opløsningen for at lette dannelsen af et kompakt metaludfældning. Generelt udsættes kobber, nikkel, bly, tin, sølv og guld til elektrolytisk raffinering.
Elektrolyse spildevandsrensning
Elektrolyse anvendes til spildevandsrensning (processer med elektrokoagulation, elektroekstraktion og elektroflotation). Den elektrokemiske rengøringsmetode er en af de mest anvendte. Til elektrolyse anvendes uopløselige anoder (magnetit, blyoxid, grafit, mangan, der er afsat på en titanbase) eller opløselig (aluminium, jern).
Denne metode bruges til at isolere giftige organiske og uorganiske stoffer fra vand. F.eks. Renses kobberrør i skala med en opløsning af svovlsyre, og industrielt spildevand skal derefter rengøres ved elektrolyse med en uopløselig anode. Kobber frigøres ved katoden, som igen kan bruges i den samme virksomhed.
Alkalisk spildevand renses ved elektrolyse fra cyanidforbindelser. For at accelerere oxidationen af cyanider, øge den elektriske ledningsevne og spare energi, anvendes et tilsætningsstof i form af natriumchlorid i vand.
Elektrolyse udføres med en grafitanode og en stålkatode. Cyanider ødelægges under elektrokemisk oxidation og klor, der frigives på anoden. Effektiviteten af en sådan rengøring er tæt på 100%.
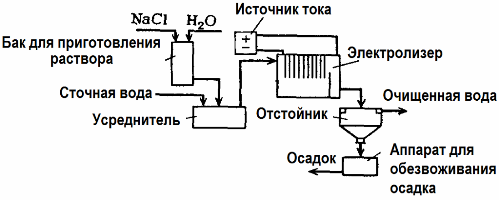
Ud over direkte elektrokemisk rengøring kan det inkluderes i elektrolyseprocessen koagulation. Bortset fra tilsætning af salte udføres elektrolyse med opløselige aluminium- eller jernanoder. Derefter ødelægges ikke kun forurenende stoffer på anoden, men selve anoden opløses. Der dannes aktive dispergerede forbindelser, der koagulerer (fortykner) kolloidale spredte forurenende stoffer.
Denne metode er effektiv til behandling af spildevand fra fedt, olieprodukter, farvestoffer, olier, radioaktive stoffer osv. Det kaldes elektrokoagulation.
galvanisering
Elektroplettering er elektrolytisk afsætning af visse metaller for at beskytte produkter mod korrosion og for at give dem et passende æstetisk udseende (belægning er lavet med chrom, nikkel, sølv, guld, platin osv.). Tingene rengøres grundigt, affedtes og bruges som katode i et elektrolytisk bad, hvori en saltopløsning af metallet, som det er nødvendigt at belægge produktet, hældes.
En plade af samme metal bruges som anoden. Som regel bruges et par anodeplader, og emnet, der skal galvaniseres, placeres mellem dem.
galvanoplastics
Elektroplettering - deponering af metal på overfladen af forskellige kroppe til gengivelse af deres former: forme til støbning af dele, skulpturer, trykte klichier osv.

Galvanisk afsætning af metal på overfladen af et objekt er kun muligt, når denne overflade eller hele genstanden er en elektrisk strømleder, så det tilrådes at bruge metaller til at fremstille modeller eller former. Smeltbare metaller er bedst egnede til dette formål: bly, tin, sælgere, trælegering.
Disse metaller er bløde, let behandles med metalbearbejdningsværktøjer, er godt indgraveret og støbt. Efter opbygning af det galvaniske lag og efterbehandling smeltes formmetallet fra det færdige produkt.
Imidlertid er de største muligheder for fremstilling af modeller stadig repræsenteret af dielektriske materialer. For at metallisere sådanne modeller er det nødvendigt at give deres overflade elektrisk ledningsevne. Succes eller fiasko afhænger i sidste ende hovedsageligt af kvaliteten af det ledende lag. Dette lag kan påføres på en af tre måder.
Den mest almindelige måde er grafitirovanie, det er velegnet til modeller af plasticin og andre materialer, der tillader formaling af grafit på overfladen.
Det næste trick er bronzering, metoden er god til modeller med relativt kompleks form, for forskellige materialer, men på grund af tykkelsen af bronzelaget er overførslen af små dele noget forvrænget.
Og endelig silveringegnet i alle tilfælde, men især uundværlig til skrøbelige modeller med en meget kompleks form - planter, insekter osv.
Kemiske strømkilder
Elektrolyse er også den vigtigste proces, som de mest avancerede kemiske strømkilder, såsom batterier og akkumulatorer, fungerer på. Der er to elektroder i kontakt med elektrolytten.
En potentiel forskel etableres mellem elektroderne - en elektromotorisk kraft svarende til redox-reaktionens frie energi. Se her for flere detaljer: Kemiske kilder til elektrisk strøm
Citronbatteri (klik på billedet for at forstørre)
Virkningen af kemiske strømkilder er baseret på forekomsten af rumligt adskilte processer med et lukket eksternt kredsløb: på den negative anode oxideres reduktionsmidlet, de frie elektroner, der dannes, passerer gennem det ydre kredsløb til den positive katode, hvilket skaber en udledningsstrøm, hvor de deltager i oxidationsreduktionsreaktionen. Således går strømmen af negativt ladede elektroner langs det eksterne kredsløb fra anoden til katoden, det vil sige fra den negative elektrode til den positive.
Se også på elektrohomepro.com
: