kategorier: Udvalgte artikler » Begynderelektrikere
Antal visninger: 36288
Kommentarer til artiklen: 1
Kemiske strømkilder: vigtigste egenskaber
 I mere end to århundreder har menneskeheden brugt energien fra kemiske reaktioner mellem forskellige stoffer til at producere jævnstrøm.
I mere end to århundreder har menneskeheden brugt energien fra kemiske reaktioner mellem forskellige stoffer til at producere jævnstrøm.
Arbejdsprincip
Redoxreaktionen, der forekommer mellem stoffer med egenskaberne af et oxidationsmiddel og et reduktionsmiddel, ledsages af frigivelse af elektroner, hvis bevægelse danner en elektrisk strøm. For at bruge dens energi er det imidlertid nødvendigt at skabe betingelser for passage af elektroner gennem et eksternt kredsløb, ellers frigives det til det ydre miljø ved blot at blande oxidationsmidlet og reduktionsmidlet med varme.
Derfor har alle kemiske strømkilder to elektroder:
-
den anode, hvorpå oxidation finder sted;
-
katode, der udfører restaurering af stoffet.
Elektroder på afstand placeres i et kar med en elektrolyt - et stof, der leder elektrisk strøm på grund af processerne med dissociation af mediet til ioner.
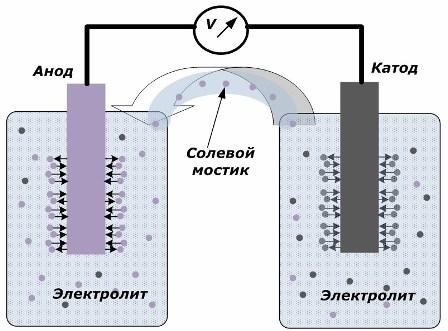
Princippet om konvertering af kemisk energi til elektrisk energi
Figuren viser, at elektroderne er placeret i separate kar, der er forbundet med en saltbro, gennem hvilken bevægelsen af ioner langs det indre kredsløb skabes. Når de eksterne og interne kredsløb er åbne, forekommer der to processer på elektroderne: overgangen af ioner fra metallet fra elektroden til elektrolytten og overgangen af ioner fra elektrolytten til krystalgitteret på elektroderne.
Strømningshastighederne for disse processer er de samme, og spændingspotentialerne for modsatte tegn akkumuleres på hver elektrode. Hvis de er forbundet via en saltbro og en belastning påføres, vil der opstå et elektrisk kredsløb. En intern strøm genereres ved bevægelse af ioner mellem elektroderne gennem elektrolytten og saltbroen. Bevægelse af elektroner langs det eksterne kredsløb i retning fra anoden til katoden.
Næsten alle redoxreaktioner ledsages af elproduktion. Men dens værdi afhænger af mange faktorer, herunder volumener og masser af de anvendte kemikalier, materialerne, der bruges til at fremstille elektroderne, såsom elektrolyt, ionkoncentration, design.
De mest udbredte i moderne kemiske strømkilder er:
-
til materialet i anoden (reduktionsmiddel) - zink (Zn), bly (Pb), cadmium (Cd) og nogle andre metaller;
-
til katodematerialet (oxidator) - blyoxid PbO2, manganoxid MnO2, nikkelhydroxid NiOOH og andre;
-
elektrolytter baseret på opløsninger af syrer, alkalier eller salte.
Klassificeringsmetoder
Den ene del af kemiske kraftkilder kan genbruges, mens den anden ikke kan. Dette princip tages som grundlag for deres klassificering.
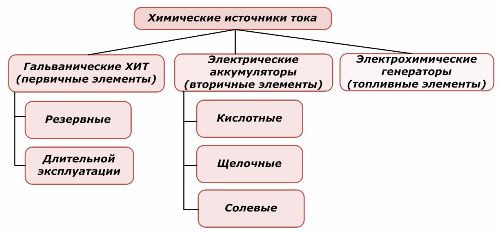
Klassificering af kemiske elementer
Elektromotorisk kraft galvaniske cellerafhængigt af designet når 1,2 ÷ 1,5 volt. For at opnå store værdier kombineres de i batterier og forbinder i serie. Når batterierne er parallelt tilsluttet, stiger strømmen og strømmen.
Det accepteres generelt, at primære kemiske strømkilder ikke understøtter genopladning, selvom denne position mere præcist kan formuleres forskelligt: dens implementering er ikke økonomisk gennemførlig.
Redundante primære kemiske strømkilder opbevares i en tilstand, hvor elektrolytten er isoleret fra elektroderne. Dette eliminerer forekomsten af redox-reaktionen og sikrer beredskab til idriftsættelse. De genbruges ikke. Opbevaringstiden for kemiske backup-strømkilder er begrænset til 10-15 år.
Batterier genoplades med anvendelse af ekstern elektrisk energi. På grund af denne funktion kaldes de sekundære strømkilder. De er i stand til at modstå hundreder og tusinder af ladeafladningscyklusser.Batteriets EMF kan ligge i området 1,0 ÷ 1,5 volt. De kombineres også til batterier.
Elektrokemiske generatorer fungerer efter princippet om galvaniske celler, men for at udføre den elektrokemiske reaktion kommer stoffer udefra, og alle frigivne produkter fjernes fra elektrolytten. Dette giver dig mulighed for at organisere en kontinuerlig proces.
De vigtigste egenskaber ved kemiske kraftkilder
1. Spændingen over åbne klemmer
Afhængigt af designet kan en enkelt kilde kun skabe en bestemt potentialeforskel. Til brug i elektriske apparater kombineres de i batterier.
2. Specifik kapacitet
I en bestemt tid (i timer) kan en kemisk strømkilde generere en begrænset mængde strøm (i ampere), der tilskrives en vægt- eller volumenhed.
3. Effektdensitet
Det kendetegner en vægt- eller volumenhed af en kemisk strømkilde til at generere strøm genereret af produktet af spænding med strømstyrken.
4. Driftsvarighed
Denne parameter kaldes også udløbsdatoen.
5. Værdien af selvudladningsstrømme
Disse sideprocesser af elektrokemiske reaktioner fører til forbrug af den aktive masse af elementerne, forårsager korrosion og reducerer den specifikke kapacitet.
6. Produktpris
Afhænger af design, anvendte materialer og en række andre faktorer.
De bedste kemiske strømkilder er dem med høje værdier for de første fire parametre, og selvudladning og omkostninger er lave.
Principper for batteriopladning
Blandt sekundære kemiske strømkilder vinder de stor popularitet. lithium-ion-modeller, som er blevet vidt brugt til at drive elektroniske enheder. De bruger LiMO2 (M Co, Ni, Mn) som materiale i den positive elektrode og grafit som den negative elektrode.
Ved ladning frigøres lithiumioner fra den påførte eksterne energi fra katodemetallet, passerer gennem elektrolytten og trænger ind i rummet mellem grafitlagene og akkumuleres der.
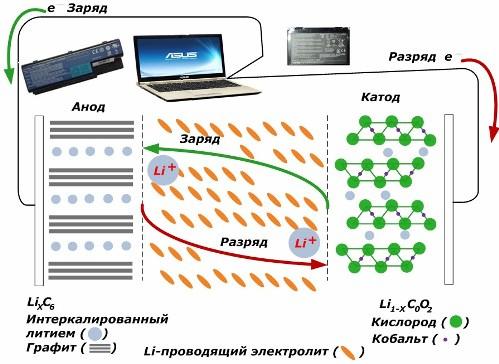
Når energien oplader er fraværende, og belastningen er forbundet til elektroderne, så lithiumioner i elektrolytten bevæger sig i den modsatte retning.
Hvis opladningen og afladningen ikke udføres, forbruges energien i batteriet ikke, men opbevares. Men dens mængde er begrænset af egenskaberne for de anvendte materialer. For eksempel i lithium-ion-batterier er den specifikke elektriske kapacitet 130 ÷ 150 mAh / g. Det er begrænset af anodematerialets egenskaber. For grafit er kapaciteten omkring to gange højere.
Forskere leder nu efter måder at øge batterikapaciteten og undersøger muligheden for at bruge en kemisk reaktion mellem lithium og ilt i luften. For at gøre dette udvikles design med en luft, ikke-forbrugsbar katode, der bruges i separate batterier. Denne metode kan øge energitætheden op til 10 gange.
Drift af kemiske strømkilder kræver viden grundlæggende elementer i elektroteknik, elektrokemi, materialevidenskab og faststoffysik.
Se også på elektrohomepro.com
:
