kategorier: Udvalgte artikler » Begynderelektrikere
Antal visninger: 70526
Kommentarer til artiklen: 0
Galvaniske celler - enhed, driftsprincip, typer og hovedegenskaber
Forudsætninger for udseendet af galvaniske celler. Lidt historie. I 1786 opdagede den italienske professor i medicin, fysiolog Luigi Aloisio Galvani et interessant fænomen: musklerne på bagbenene i et nyåbnet lig af en frø ophængt på kobberkrog trak sig sammen, da forskeren rørte ved dem med en stålskalpel. Galvani konkluderede straks, at dette var en manifestation af "animalsk elektricitet."
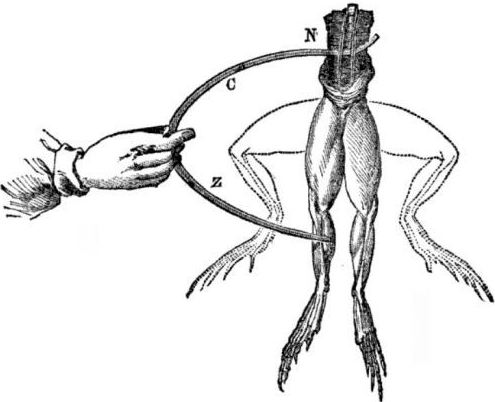
Efter Galvanis død vil hans moderne Alessandro Volta, som kemiker og fysiker, beskrive og offentligt demonstrere en mere realistisk mekanisme for forekomsten af elektrisk strøm, når forskellige metaller kommer i kontakt.
Efter en række eksperimenter vil Volta komme til den entydige konklusion, at strømmen vises i kredsløbet på grund af tilstedeværelsen i to ledere af forskellige metaller placeret i en væske, og dette er slet ikke "animalsk elektricitet", som Galvani troede. Ritningen af frøens ben var en konsekvens af virkningen af strømmen, der skyldes kontakten af forskellige metaller (kobberkroge og en stål skalpell).
Volta vil vise de samme fænomener, som Galvani viste på en død frø, men på et helt livløst hjemmelavet elektrometer, og i 1800 vil give en nøjagtig forklaring af strømmen: ”den anden klasse leder (væske) er i midten og er i kontakt med to førsteklassede ledere af to forskellige metaller ... Som et resultat heraf opstår en elektrisk strøm i en eller anden retning. ”

I en af de første eksperimenter sænkede Volta to plader - zink og kobber - i en krukke med syre og forbandt dem med ledning. Derefter begyndte zinkpladen at opløses, og gasbobler dannedes på kobberstålet. Volta foreslog og beviste, at elektrisk strøm strømmer gennem ledningen.
Således blev opfundet "Volta-elementet" - den første galvaniske celle. For nemheds skyld gav Volta ham formen som en lodret cylinder (søjle) bestående af sammenkoblede ringe af zink, kobber og klud imprægneret med syre. En voltpol, en halv meter høj, skabte en spænding, der er følsom for mennesker.
Siden starten af forskningen blev lagt af Luigi Galvani, navnet kemisk strømkilde bevaret mindet om ham i hans navn.
Galvanisk celle Er en kemisk kilde til elektrisk strøm, baseret på samspillet mellem to metaller og / eller deres oxider i en elektrolyt, hvilket fører til udseendet af en elektrisk strøm i et lukket kredsløb. I galvaniske celler omdannes kemisk energi til elektrisk energi.
Celler i dag

Celler i dag kaldes batterier. Tre typer batterier er udbredt: saltvand (tør), alkalisk (de kaldes også alkalisk, "alkalisk" i oversættelse fra engelsk - "alkalisk") og lithium. Princippet for deres arbejde er det samme som beskrevet af Volta i 1800: to metaller interagere gennem elektrolyt, og en elektrisk strøm opstår i et eksternt lukket kredsløb.
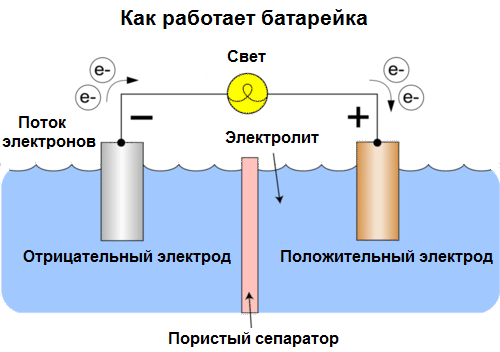
Batterispænding afhænger af de anvendte metaller og af antallet af celler i "batteriet". Batterier er i modsætning til batterier ikke i stand til at gendanne deres egenskaber, da de direkte omdanner kemisk energi, det vil sige energien fra reagenserne (reduktionsmiddel og oxidator), der udgør batteriet, til elektrisk energi.
De reagenser, der er inkluderet i batteriet, forbruges under dets drift, strømmen falder gradvist, og derfor ender kildens virkning, når reagenserne fuldstændigt reagerer.
Alkaliske og saltelementer (batterier) bruges i vid udstrækning til at drive forskellige elektroniske enheder, radioudstyr, legetøj og lithium kan ofte findes i bærbare medicinske apparater, såsom blodsukkermåler eller i digital teknologi, såsom kameraer.

Saltbatterier
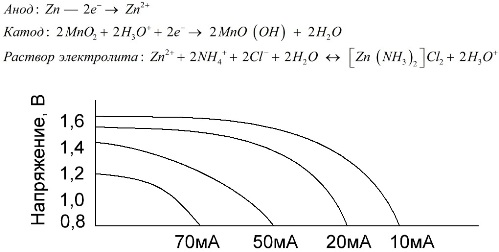
Mangan-zinkceller, der kaldes saltbatterier, er "tørre" galvaniske celler, hvori der ikke findes nogen flydende elektrolytopløsning.
En zinkelektrode (+) er en kopformet katode, og en pulveriseret blanding af mangandioxid og grafit tjener som anode. Strøm flyder gennem en grafitstang. Som en elektrolyt bruges en pasta fra en opløsning af ammoniumchlorid med tilsætning af stivelse eller mel til at blive tykkere, så intet flyder.
Typisk angiver batteriproducenter ikke den nøjagtige sammensætning af saltelementerne, men saltbatterier er dog de billigste, de bruges normalt på enheder, hvor strømforbruget er ekstremt lavt: i timer, i fjernbetjeninger, i elektroniske termometre osv.

Begrebet "nominel kapacitet" bruges sjældent til at karakterisere mangan-zink-batterier, da deres kapacitet er meget afhængig af driftsforhold og -forhold. De største ulemper ved disse elementer er en betydelig spændingsreduktionshastighed gennem hele udladningen og et markant fald i outputkapacitansen med stigende udladningsstrøm. Den endelige udladningsspænding indstilles afhængigt af belastningen i området 0,7-1,0 V.
Det er vigtigt ikke kun størrelsen på udtømningsstrømmen, men også tidsplanen for belastningen. Ved periodisk afladning af store og mellemstore strømme øges ydelsen for batterierne markant sammenlignet med kontinuerlig drift. Med små afladningsstrømme og måneder med afbrydelser i drift kan deres kapacitet imidlertid falde som et resultat af selvudladning.
Grafen ovenfor viser udladningskurverne for et gennemsnitligt saltbatteri i 4, 10, 20 og 40 timer til sammenligning med et alkalisk, som vil blive diskuteret senere.
Alkaliske (alkaliske) batterier
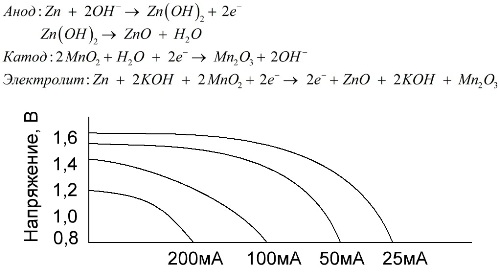
Et alkalisk batteri er et galvanisk mangan-zinkbatteri, i hvilket mangandioxid bruges som katode, pulveriseret zink bruges som en anode, og en alkaliopløsning bruges som en elektrolyt, normalt i form af en kaliumhydroxidpasta.
Disse batterier har en række fordele (især en betydelig større kapacitet, bedre ydelse ved lave temperaturer og høje belastningsstrømme).

Alkaline batterier i sammenligning med saltprodukter kan give mere strøm i lang tid. En større strøm bliver mulig, fordi zink her ikke bruges i form af et glas, men i form af et pulver med et større kontaktområde med elektrolytten. Kaliumhydroxid i form af en pasta anvendes som elektrolyt.
Det er takket være denne type galvaniske cellers evne til at levere en betydelig strøm (op til 1 A) i lang tid, alkaliske batterier er mest almindelige på nuværende tidspunkt.
I elektriske legetøj, i bærbart medicinsk udstyr, i elektroniske apparater, i kameraer bruges alkaliske batterier overalt. De tjener 1,5 gange længere end saltvand, hvis udladningen er lav strøm. Grafen viser udladningskurverne ved forskellige strømme til sammenligning med et saltbatteri (grafen blev angivet ovenfor) i 4, 10, 20 og 40 timer.
Lithium-batterier
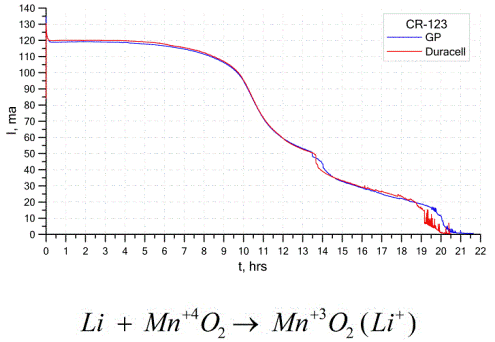
En anden temmelig almindelig type galvaniske celler er lithiumbatterier - enkelte ikke-genopladelige galvaniske celler, hvor lithium eller dets forbindelser bruges som anode. På grund af brugen af alkalimetal har de en stor potentialeforskel.

Katoden og elektrolytten i en lithiumcelle kan være meget forskellige, så udtrykket "lithiumcelle" kombinerer en gruppe celler med det samme anodemateriale.Som en katode kan for eksempel mangandioxid, carbonmonofluorid, pyrit, thionylchlorid osv. Anvendes.
Lithium-batterier adskilles fra andre batterier ved deres høje driftstid og høje omkostninger. Afhængigt af den valgte størrelse og de anvendte kemiske materialer kan et lithiumbatteri producere spændinger fra 1,5 V (kompatibel med alkaliske batterier) til 3,7 V.
Disse batterier har den højeste kapacitet pr. Enhedsmasse og lang holdbarhed. Lithiumceller bruges i vid udstrækning i moderne bærbart elektronisk udstyr: til at tænde ure på computer bundkort, til at tænde bærbart medicinsk udstyr, ure, lommeregnere, i fotografisk udstyr osv.
Grafen ovenfor viser udladningskurverne for to litiumbatterier fra to populære producenter. Den indledende strøm var 120 mA (pr. Modstand i størrelsesordenen 24 ohm).
Se også: Moderne genopladelige batterier - fordele og ulemper
Se også på elektrohomepro.com
: